Питома теплота згоряння гасу
Основні теплофізичні характеристики гасу
Гас - це середній дистилят процесу нафтопереробки, який визначається як частка сирої нафти, що кипить при температурі від 145 до 300°C. Гас може бути отриманий шляхом перегонки сирої нафти (прямогінний гас) або з крекінгу більш важких нафтових потоків (крекінг-гас).
Сирий гас має властивості, які роблять цей нафтопродукт придатним для змішування з різними експлуатаційними добавками, що визначають його використання у різних комерційних цілях, у тому числі у транспортному паливі. Гас є складною сумішшю сполук з розгалуженим і прямим ланцюгом, які зазвичай можна розділити на три класи: парафіни (55,2% за масою), нафтени (40,9%) та ароматичні сполуки (3,9%).


Для ефективності застосування всі марки гасу повинні володіти максимально можливою питомою теплотою згоряння та питомою теплоємністю, а також характеризуватись досить широким діапазоном температур запалення. Для різних груп гасів ці показники становлять:
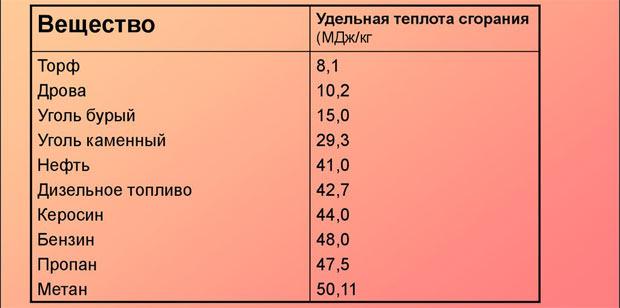
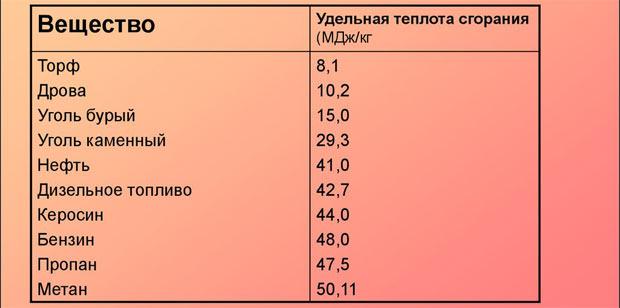
- Питома теплота згоряння, кДж/кг – 43000±1000.
- Температура самозаймання, 0З, не нижче – 215.
- Питома теплоємність гасу за кімнатної температури, Дж/кг·К – 2000…2020.
Точно встановити більшість теплофізичних показників гасу неможливо, оскільки сам продукт не має постійного хімічного складу та визначається характеристиками вихідної нафти. Крім того, щільність та в'язкість гасу залежить від зовнішніх температур. Відомо лише, що з наближенням температури до зони стійкого горіння нафтопродукту, питома теплоємність гасу істотно підвищується: при 2000З вона становить вже 2900 Дж/кг К, а при 2700З - 3260 Дж/кг К. До. Відповідно знижується кінематична в'язкість. Сукупність цих параметрів визначає гарне та стійке запалення гасу.

Послідовність визначення питомої теплоти згоряння
Показник питомої теплоти згоряння гасу встановлює умови його займання у різних пристроях – від двигунів до апаратів гасового різання. У першому випадку оптимальне поєднання теплофізичних параметрів слід визначати ретельніше. Для кожної комбінації палива зазвичай встановлюється кілька графіків. Ці графіки можуть бути використані для оцінки:
- Оптимального співвідношення суміші продуктів згоряння.
- Адіабатична температура полум'я реакції згоряння.
- Середня молекулярна маса продуктів згоряння.
- Питома теплота співвідношення продуктів згоряння.
Ці дані необхідні визначення швидкості вихлопних газів, що викидаються з двигуна, що у свою чергу визначає тягу двигуна.


Оптимальне співвідношення паливної суміші дає найвищий питомий імпульс енергії та є функцією тиску, при якому працюватиме двигун. Двигун з високим тиском у камері згоряння та низьким тиском на виході матиме найвище оптимальне співвідношення суміші. У свою чергу, від оптимального співвідношення суміші залежить тиск у камері згоряння та енергоємність гасового палива.
У більшості конструкцій двигунів, що використовують гас як паливо, велика увага приділяється умовам адіабатичного стиснення, коли тиск і об'єм, що займається горючою сумішшю, знаходяться в постійному взаємозв'язку – це впливає на довговічність елементів двигуна. При цьому зовнішній теплообмін, як відомо, відсутній, що визначає максимальний ККД.


Питома теплоємність гасу - це кількість тепла, необхідне підвищення температури одного грама речовини на градус Цельсія. Коефіцієнт питомої теплоємності - це відношення питомої теплоємності при постійному тиску до питомої теплоємності при постійному обсязі. Оптимальне співвідношення встановлюють заздалегідь заданому тиску палива в камері згоряння.
Точні показники теплоти при згорянні гасу зазвичай не встановлюють, оскільки цей нафтопродукт є сумішшю чотирьох вуглеводнів: додекану (C12H26), тридекану (C13H28), тетрадекану (C14H30) і пентадекан (C15H32). Навіть у межах однієї партії вихідної нафти відсоткове співвідношення перелічених компонентів перестав бути постійним. Тому теплофізичні характеристики гасу завжди підраховують з відомими спрощеннями та припущеннями.

